問 題
0.20 mol/L 塩化アンモニウム水溶液 100 mL を用いてアンモニア・塩化アンモニウム緩衝液 (pH 9.0) を調製したい。この塩化アンモニウム水溶液に加える 0.18 mol/L アンモニア水溶液の液量に最も近い値はどれか。1 つ選べ。
ただし、アンモニアの pKb = 4.7、水のイオン積 [H+][OH-] = 1.0 × 10-14 (mol/L)2、100.3 = 2とし、混合により各水溶液の体積は変化しないものとする。
- 15mL
- 35mL
- 55mL
- 75mL
- 95mL
解 説
緩衝溶液、pH と来たら Henderson-Hasselbalch (ヘンダーソン-ハッセルバルヒ)の式です。(参考 104-91 酸性の緩衝溶液についての pH を求める問題)。塩基性化合物なので、pH = pKa + log [分子形]/[イオン形] (塩基性化合物の場合) を思い出します。本問では、分子形とは[NH3]、イオン形とは[NH4+]です。
アンモニアの pKb = 4.7 と与えられており、また、pKa + pKb = 14 は基礎知識です。これにより、pKa = 14 – 4.7 = 9.3 です。
[NH4+] は、0.20 mol/L で 100 mL = 0.1L なので、0.20 × 0.1 = 0.02 mol です。調製したい pH = 9.0、pKa = 9.3、[NH4+] = 0.02 を代入すると、以下のようになります。100.3 = 2 と与えられていることを活用することで、[NH3] を求めることができます。
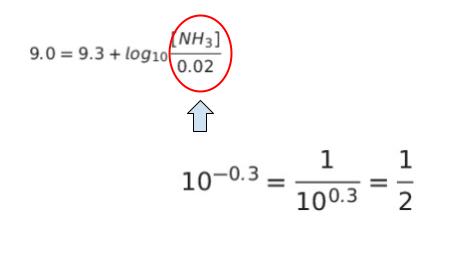
すなわち、[NH3]/0.02 = 1/2 であることから、[NH3] は 0.01 です。この結果、本問は「0.18 mol/L アンモニア水溶液 が 何 mL で、0.01mol か」という問題に帰着します。選択肢から選ぶなら 55 mL が妥当です。
以上より、正解は 3 です。

コメント