問 題
生体における化学反応は約 37℃ で進行するが、化学反応は温度の影響をうけるため熱力学パラメーターの温度依存性を知ることは重要なことである。
圧力一定条件下での温度Tと熱力学パラメータ (ΔrG°、ΔrH°、TΔrS°) の関係が図のようになる化学反応に関する記述のうち、正しいのはどれか。2つ選べ。
ただし、ΔrG°、ΔrH°、ΔrS° は、それぞれ標準反応ギブズエネルギー、標準反応エンタルピー、標準反応エントロピーを表す。
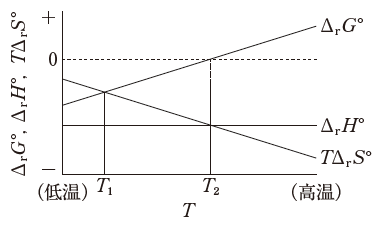
- この化学反応は、発熱反応である。
- 温度 T1 での平衡定数は、温度 T2 での平衡定数よりも小さい。
- 温度が T2 より高温側での平衡定数は、1より小さい。
- 温度が T2 より低温側では、この反応はエントロピー駆動となる。
- 温度が T2 よりも低温側では、反応の進む向きは反応物と生成物の初期濃度に依存しない。
解 説
選択肢 1 は妥当です。
発熱か吸熱かというのは、定圧過程であれば、標準反応エンタルピー ΔrH° が負か正かという問題です。負なので、発熱です。
選択肢 2 ですが
平衡定数と来たので、ΔG = -RT lnK を思い出します。変形して、K = e-ΔG/RT です。また、ΔG = ΔH – TΔS です。
温度 T2 において、ΔH = TΔS になっています。従って、ΔG = 0 です。温度 T2 の時、K = e0 = 1 とわかります。
一方、温度 T1 では、TΔS の方が大きいため、ΔG は負となり、K = e正の数 です。ex は単調増加する関数です。従って、e正の数 の方が大きいです。つまり、温度 T1 の時の方が平衡定数は大きいとわかります。選択肢 2 は誤りです。
選択肢 3 は妥当です。
温度 T2 の時に、平衡定数は 1 です。T がもっと大きくなると、TΔS の方が小さいため、ΔG は正です。すると、平衡定数は K = e負の数 です。従って、1より小さくなります。
選択肢 4 ですが
温度 T2 より低温側において ΔG が負となるのは、Δ H がある程度大きな負の値をもっているからと考えられます。従って「エンタルピー駆動」です。エントロピー駆動ではありません。選択肢 4 は誤りです。
選択肢 5 ですが
T2 より低温側において、適当に K = 2 になるような温度を考えます。この時、反応物と生成物の比が1:2の状態で安定します。そうであれば、初期濃度がこれよりも反応物の方が多ければ、反応物が減る方向に反応が進行します。逆に、初期濃度において反応物の方が少なければ、反応物が増える方向に反応が進行すると考えられます。従って、初期濃度に依存します。選択肢 5 は誤りです。
以上より、正解は 1,3 です。

コメント