問 題
未知タンパク質Xを分離精製し、その特性を解析した。
問119
タンパク質Xを含む細胞抽出液(試料ア)をドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動(SDS-PAGE)及びサイズ排除クロマトグラフィー(SEC)により分析した。SDS-PAGEに際し、試料アにSDSと2-メルカプトエタノールを添加して前処理した(試料イ)。
図1のレーンAは分子量が25kDa、35kDa、40kDa、55kDaの4種の分子量マーカータンパク質を示し、レーンBは試料イを分離したときの泳動結果である。図2は精製したタンパク質X溶液(試料ウ)と上記の4種の分子量マーカータンパク質を混合して分離したときのクロマトグラムである。
以下の記述のうち、正しいのはどれか。2つ選べ。
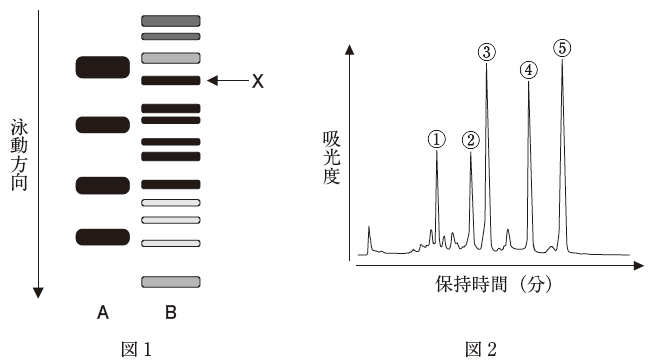
- SDS-PAGEでは、試料イのようにタンパク質をSDSと2-メルカプトエタノールで酸化的に前処理することで分子量に基づいた分離が可能になる。
- SDS-PAGEにおいて、タンパク質は陰極から陽極に向かって移動する。
- タンパク質Xの分子量は、40kDaから55kDaの間である。
- SECの固定相として、プロテインA固定化シリカゲルが用いられる。
- SECによりタンパク質Xが単量体として溶出されるとき、そのピークは④である。
問120
精製したタンパク質Xは単量体で酵素活性をもち、その活性発現には補因子を必要としないことが判明した。次に、タンパク質Xに対する1種類のモノクローナル抗体(anti-X)をマウスを用いて作製した。
タンパク質Xの酵素活性、抗体作製及び細胞内局在の解析に関する記述のうち、正しいのはどれか。2つ選べ。ただし、精製の過程で酵素活性が失われることはなかった。
- 試料イにおけるタンパク質Xの酵素活性は、試料アよりも高い。
- タンパク質Xの比活性*は、試料アよりも試料ウにおいて高い。
- anti-Xを産生するハイブリドーマの作製には、マウス骨髄腫細胞が用いられる。
- anti-Xは、タンパク質X中の複数の異なるエピトープ(抗原決定基)を認識する。
- anti-Xと試料イを用いたウエスタンブロット法により、タンパク質Xの細胞内局在を同定することができる。
*比活性:試料中のタンパク質の単位重量当たりの酵素活性
正解.
問119:2, 3
問120:2, 3
解 説
問119
選択肢 1 ですが
2ーメルカプトエタノールは、「還元」剤です。酸化的ではなく、還元的前処理です。この前処理で分子量に基づいた分離が可能になるという部分は適切です。
選択肢 2,3 は、正しい記述です。
SDS-PAGEでの泳動方向と極については頻出ですが、前処理で負電荷をタンパク質に付加する という点をイメージできると思い出しやすいです。
選択肢 4 ですが
プロテインA固定化ゲルは免疫沈降法で用います。SECでの固定相ではありません。よって、選択肢 4 は誤りです。
選択肢 5 ですが
SECでは、分子量が小さい方が遅く出てきます。つまり、保持時間が長いということです。従って、順に1が55k、2がX、3が40k、4が35k、5が25k のピークと考えられます。よって、選択肢 5 は誤りです。
以上より、正解は 2,3 です。
問120
選択肢 1 ですが
試料イは、前処理済なので SDS で変性しています。精製の過程で失活はしていないとありますが一般的に、活性は低下すると考えられます。少なくともこの処理により酵素活性が高くなるとはいえません。よって、選択肢 1 は誤りです。
選択肢 2,3 は、正しい記述です。
選択肢 4 ですが
anti-X はモノクローナルです。モノクローナルとは、認識するエピトープが単一 ということです。記述はポリクローナルに関するものです。よって、選択肢 4 は誤りです。
選択肢 5 ですが
細胞内局在の同定には、例えば目的タンパク質をコードする部分の遺伝子に蛍光タンパク質(GFP等)のコードを挿入した上で遺伝子を細胞内に導入し細胞培養した上で、蛍光を測定するといった手法を取ります。
ウエスタンブロットは、試料からタンパク質 X のみを検出する方法です。これでわかるのは「確かに試料には、タンパク質 X があるよ」ということです。細胞内のどこにあったか はわかりません。よって、選択肢 5 は誤りです。
以上より、正解は 2,3 です。

コメント