問 題
70歳男性。高血圧症で処方1を服用していた。ある日胸部不快感を自覚し、かかりつけのクリニックを受診した。心房細動の疑いがあることから、精査目的で市内の総合病院を紹介され受診したところ、心房細動、心不全と診断され、処方2が追加となった。

問324
処方2に含まれるダビガトランエテキシラートによる重篤な副作用である出血の回避や投与量の調節のために考慮すべき検査項目はどれか。1つ選べ。
- 血清クレアチニン値
- AST値
- 白血球数
- PT-INR値
- 脳性Na利尿ペプチド値
問325
重篤な副作用を回避するための確認は行われていたものの、後日、この男性に重大な副作用が発現した。
薬剤師は主治医と相談のうえ、この男性の副作用について、医薬品・医療機器等安全性情報報告制度に基づき報告することを決めた。下図は、記入途中の医薬品安全性情報報告書の一部である。この制度の説明として、正しいのはどれか。2つ選べ。
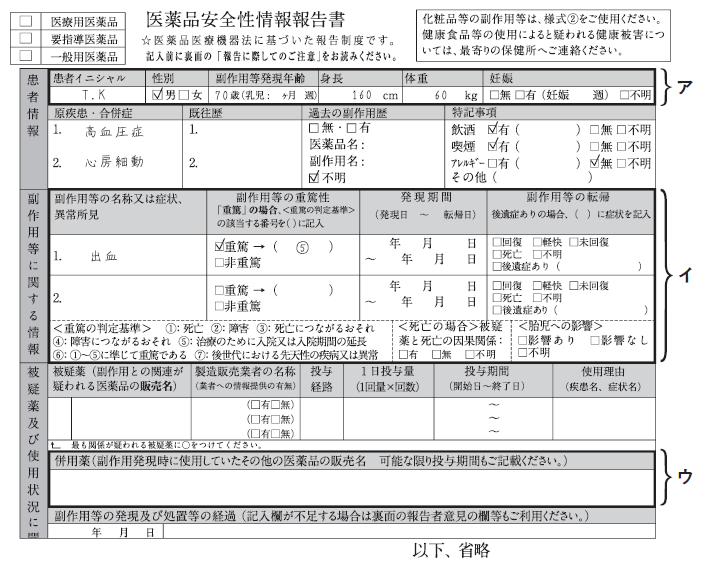
- この男性の場合、厚生労働大臣への報告期限は、発生を知った日から30日以内である。
- 添付文書などから予測できない未知の症例についても報告する。
- 患者情報のうち、アに記載された内容は、公開されることはない。
- イの項目はすべて記入しなければならない。
- クリニックで処方された(処方1)の薬剤も、ウに記載する。
正解.
問324:1
問325:2, 5
解 説
問324
ダビガトラン(プラザキサ)は、腎排泄型の直接トロンビン阻害薬です。副作用回避のためにクレアチニンクリアランスを考慮し、腎機能が弱っている患者への投与は避けます。
従って、正解は 1 です。
問325
選択肢 1 ですが
特に報告期限はありません。(ただし、適宜速やかな報告が望まれます。)よって、選択肢 1 は誤りです。
選択肢 2 は、正しい記述です。
保健衛生上の危害の発生又は防止するために必要があると認める時に報告する制度なので、未知の症例についても報告をします。
選択肢 3 ですが
アの部分は公開されます。
選択肢 4 ですが
分かる部分をできるだけ記入します。
選択肢 5 は、正しい記述です。
以上より、正解は 2,5 です。

コメント