問 題
以下の化学反応式における熱力学的パラメータに関する記述のうち、誤っているのはどれか。1つ選べ。
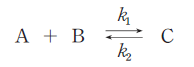
ただし、この反応における温度をT、平衡定数をK、反応速度定数をk1、k2とする。また、気体定数をRとする。
- この反応の標準自由エネルギー差ΔG°は、ΔG°=-RTlnKで表すことができる。
- いくつかの温度で測定した平衡定数から、反応の標準エンタルピー変化(ΔH°)を求めることができる。
- ΔH°が正のときは吸熱反応となり、温度を上げると平衡が左にずれる。
- 反応速度定数k1は、exp(-Ea/RT)に比例する。なお、Eaは一般に活性化エネルギーといわれる。
- 活性化エネルギーが高いほど反応速度に対する温度の影響は大きい。
解 説
選択肢 1 は、正しい選択肢です。
自由エネルギー差と平衡定数の関係式は、ΔG = ΔG° + RT lnK です。(ΔG° が、標準自由エネルギー差のことです。)また、平衡状態において、ΔG = 0 となります。従って、ΔG° = -RTlnK です。
選択肢 2 は、正しい選択肢です。
Δ G° = ΔH° - TΔS° です。選択肢 1 より、ある温度において平衡定数がわかれば、その温度における ΔG°がわかります。すると、その温度において、ΔH° と、ΔS° に関する式が一つできます。温度を変えてもう一つ式を作れば、変数が2つで式が2つなので、解くことができます。
選択肢 3 ですが
ΔH°が正ならば、吸熱反応です。温度を上げると、温度を下げる方=吸熱する方向に平衡がずれると考えられます。つまり、平衡は右にずれます。よって、選択肢 3 が誤りです。
選択肢 4 は、正しい選択肢です。
アレニウスの式によれば、k = A exp(-Ea/RT)です。 従って、比例しています。※「exp(~)というのは、e~ の別の表記です。」
選択肢 5 は、正しい記述と考えられます。
アレニウスの式における、-Ea/RT という、e の指数部分に注目すれば、Ea = 100000(大きい一例) とすると、T が 300 の場合 -333.3/R ≒ -40、T が 400 の場合 -250/R ≒ -30 となります。つまり、温度が 100 違う場合に、指数部分が約10異なります。(R を大体 8 として計算しました。)
一方、Eaが100(小さい一例)だと、Tが300の場合 、-0.33/R ≒ -0.04、Tが400の場合、-0.25/R ≒ -0.03 と、温度が 100 違う場合に、指数の部分は 約 0.01 程度しか異なりません。
活性化エネルギー、すなわち Ea が大きいと、その分温度変化に伴って指数部分が大きく変化するため、反応速度定数 k も大きく変化します。従って、反応速度に対する温度の影響が大きいといえます。
以上より、正解は 3 です。

コメント