問 題
オゾン(O3)の構造式として最もふさわしいのはどれか。1つ選べ。
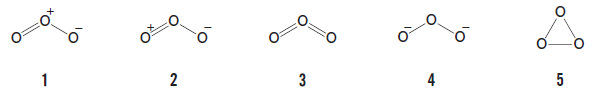
正解.1
解 説
オゾンは問題文にもある通り、O3 で表される分子です。その構造は、3つの酸素原子が折れ線型に並んでいて電荷の配置は 1 のようになっています。
2 の場合、左側の酸素に二重結合と+の両方が付いているのがおかしいです。酸素は 6 価なので左側の酸素には二重結合のほかに非共有電子対が2組あることになりますが、そうするとこの酸素は 8 電子則を満たすので+を付ける余地はありません。
3 の場合、中央の酸素には二重結合が2つ付いていますが、酸素は 6 価なので、このほかに非共有電子対を 1 組持つことになります。しかし、そうするとこの酸素の価電子は 10 になってしまい 8 電子則に反するので、この構造も誤りです。
4 では、分子全体の電荷の合計が 0 になっていない点がおかしいです。また、分子全体の価電子数を数えると20(=7+6+7)になっていて O3 が本来持つべき 18 個と合いません。よって、これも誤りです。
5について、炭素の三員環(シクロプロパン)や、炭素 2 つと酸素 1 つから成る三員環(エポキシド)ならともかく、酸素のみの三員環だと高エネルギー過ぎるので分子として成立しません。
以上の通り、選択肢 2~5 はどれも不適切ですが、1 はこのような不備や矛盾がないので、1 が正しい構造式となります。

コメント