問 題
図のように、断熱容器Ⅰ、Ⅱがコックが付いた細管で連結されている。Ⅱの容積はⅠの容積の 2 倍でありコックを開いた状態で、これらの容器にある理想気体を封入したところ、温度が300K、圧力が 1.00 × 105Pa となった。
コックを閉じて、容器Ⅱの気体のみを加熱し温度を 480K にした後、加熱を止め、コックを開いた。平衡状態となったときの容器内の圧力はおよそいくらか。ただし容器の熱膨張、容器をつなぐ細管の容積は無視できるものとし細管及びコックと封入した気体との熱のやりとりはないものとする。
1.1.5×105Pa
2.1.4×105Pa
3.1.3×105Pa
4.1.2×105Pa
5.1.1×105Pa
解 説
理想気体というキーワードがあるので、PV = nRT を思い出します。
本問は「温度の違う気体をコックで分離しておき、コックを開いて混ぜた時の圧力を求める」という状況が特殊です。状態方程式だけでは「コックを開いた時に T も P も変化してしまいわけがわからない」という問題があります。
そこで、理想気体に関するもう1つの重要な基礎知識である、気体の内部エネルギーに関する「U = 3/2 nRT」 を思い出して考えます。※この式は単原子分子についての式ですが特に指定がないので単原子分子と仮定して考えます。
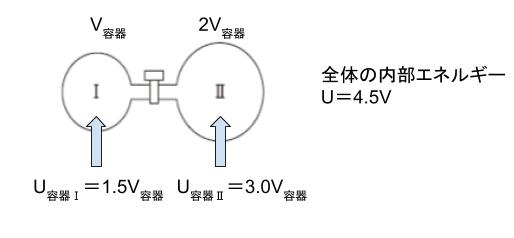
Ⅰの容積を V容器 とします。Ⅱの容積は 2V容器 です。初めの状態において、圧力は 1, 体積は 3V 容器 なので、PV = 1×3V容器 です。※ p について「× 105」は略して考えます。選択肢を見ると、係数だけわかれば答えが選べるからです。
理想気体の状態方程式(PV = nRT)より、nRT = 3V容器 と表すことができます。これを、内部エネルギーの式(U = 3/2 nRT)に代入すれば
U = 3/2 × (3V容器) = 9/2 V容器 = 4.5V容器 です。
気体はまんべんなく存在するのだから、容器Ⅰと容器Ⅱの体積比が1:2であれば気体の分布する比も1:2です。つまり、容器Ⅰの気体の内部エネルギーと、容器Ⅱの気体の内部エネルギーの比も1:2と考えられます。従って、容器Ⅰの気体の内部エネルギーは 1.5V容器、容器Ⅱの気体の内部エネルギーは 3V容器と考えられます。
次に容器Ⅱだけ加熱されて、300K → 480K になりました。T が 1.6 倍なので内部エネルギーも 1.6 倍になります。3 × 1.6 = 4.8です。4.8V容器 になります。この状態でコックを開けば、全気体の内部エネルギーは、4.8V容器 + 1.5V容器 = 6.3V容器 です。
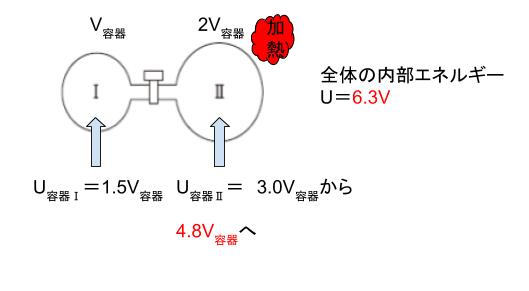
すると、U = 3/2 nRT かつ、 nRT = PV なので、U が 6.3V容器であれば、PV が 4.2V容器 とわかります。コックを開いて全体に注目しているため、Vは 3V容器 です。4.2 ÷ 3 = 1.4 なので、P = 1.4 です。
以上より、正解は 2 です。

コメント