問 題
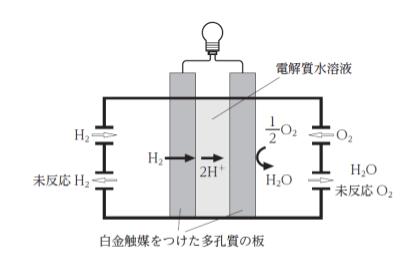
図は、電解質にリン酸を用いた燃料電池の模式図である。電極部分は、白金触媒をつけた多孔質の板であり、水素や酸素を通過させまた、電解質水溶液部分では、水溶液中を H+ が移動する。
水の標準生成ギブズエネルギーを、-237kJ・mol-1、ファラデー定数を 9.65 × 104 C・mol-1とすると、標準状態でこの電池の起電力はおよそいくらか。
1.0.615V
2.0.965V
3.1.23V
4.2.45V
5.3.08V
正解 (3)
解 説
「ギブスエネルギーと起電力の関係」ときたら ΔG = -nFE です。Eが起電力です。重要基礎知識となります。この式を思い出したら、後は「電子が何 mol 流れているか」をチェックします。
本問の燃料電池では
H2 → 2H+ + 2e–
2H+ + 2e– + 1/2 O2 → H2O という反応が進んでいるので、移動する電子は 2mol と考えられます。従って、式の n に 2 を代入します。求めるのは起電力なので
E = ーΔG/nF となおしておいて、数値を代入します。
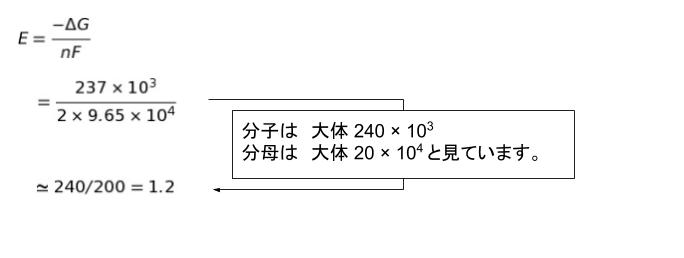
以上より、正解は 3 です
類題 薬剤師国家試験 100-95 (別サイト、別試験)

コメント