問 題
273 K において、ある活性炭に一酸化炭素を吸着させた。
一酸化炭素の圧力が 30 kPa及び 60 kPaで吸着した一酸化炭素の体積は標準状態換算でそれぞれ 5.1 mL 及び 7.7 mL であった。この吸着が Langmuir 吸着であるとすると、一酸化炭素の圧力が 50kPa のときに吸着する一酸化炭素の標準状態換算の体積はおよそいくらか。
なお、Langmuir 吸着では吸着量 V は、飽和吸着量を Vmax 気体の圧力を P 、吸着平衡定数を K として Langmuirの吸着等温式
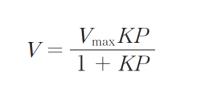
で表される。
1.5.7mL
2.6.2mL
3.6.6mL
4.7.0mL
5.7.3mL
解 説
【解法1】
「ab/a+b 型が来たら両辺逆数をとってみよう」のパタ―ンと考えます。吸着等温式は、1/V を y のようなもの、1/P を x のようなものと見れば、「y = ax + b 型」つまり「比例式」として扱うことができます。
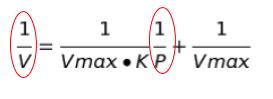
すると、横軸に 1/P,縦軸に1/V をとれば、1/30 の時,1/5.1 と、1/60 の時,1/7.7 という2点を通る直線をひけばグラフ完成です。
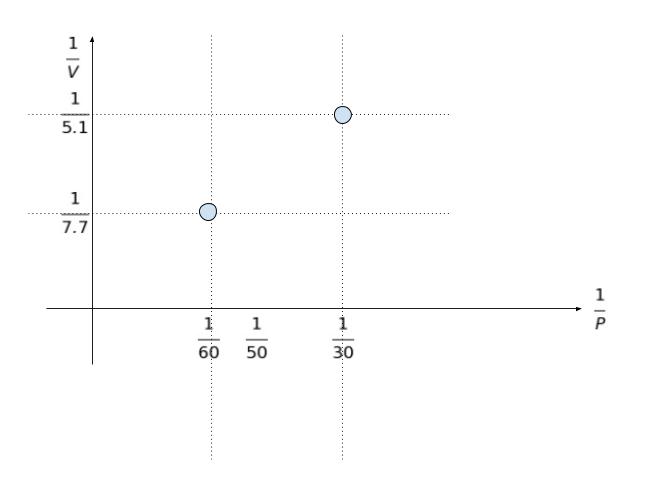
選択肢から答えを選べば、大体 7.0 が一番適切と考えられます。正解は 4 です。
※ 分数なので、単純に 1/60 と 1/30 の間を 3 等分したら1/50 になるわけではない点に注意です!
できるだけ正確に計算するなら、以下のように分母を揃えます。1/P の分母を揃えると 5/300、10/300、6/300 です。「5等分」することになります。1/5.1 と 1/7.7 も分母を揃えれば770/3927 と 510/3927 です。従って、1/P = 1/50 に対応する 1/V は 562/3927 です。V を求めると 6.98…で、ほぼ 7 となります。
【解法2】
P、V の組が 2 つわかっているので、代入して 2 つ式を作ることで、Vmax、K を求めてしまい、それから P = 50 を代入して V を求めます。
5.1 = Vmax・K・30/(1+30K)
→153K+5.1 = 30K・Vmax・・・(1)
7.7 = Vmax・K・60/(1+60K)
→462K+7.7 = 60K・Vmax・・・(2)
(2)ー2×(1)で右辺がきれいに消えるので、K がわかります。K = 2.5/156 です。代入して計算すると Vmax が大体 15 とわかります。P = 50 を代入して、V ≒ 7 を求めます。
この問題はしっかり時間をかけて、解ききりたい問題です。

コメント