問 題
分子の平均自由行路より孔径が小さい多孔質体を気体が透過するとき、気体分子はクヌーセン流れに従うことが知られている。クヌーセン流れにおいて、気体が厚さl、透過係数Cの多孔質膜を透過するときのガス透過速度 Q は、膜を挟んだ分圧差を ΔP、膜面積を A として
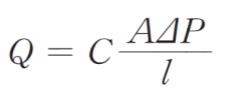
で表される。また、Cは、気体の分子量を M、絶対温度を T として膜固有の値 K を用いると
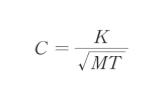
となる。
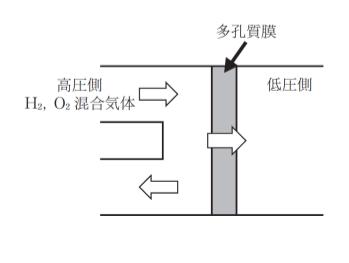
図のように、酸素の透過係数が 8.0×10-11mol・m-1・s-1・Pa-1 の多孔質膜を挟んで高圧側に水素と酸素の混合気体を供給し低圧側に気体透過を行った。
流れはクヌーセン流れに従い、高圧側は圧力が 400kPa 水素と酸素のモル比が 1:1であり、低圧側の圧力(水素分圧と酸素分圧の和)が 100kPa であったとき、低圧側における水素のモル分率はいくらか。ただし、水素と酸素の分子量をそれぞれ 2、32 とし、√73 = 8.5 とする。
1.0.65
2.0.70
3.0.75
4.0.80
5.0.85
解 説
供給側(高圧側)が水素と酸素のモル比が 1:1、つまり同モルなので「透過速度の比」がそのまま、「低圧側のモル比」になると考えられます。下図のようなイメージです。

低圧側の H2 のモル分率が問われているので、低圧側の H2 のモル分率を x とおいてみます。
H2 のみに注目してみると、高圧側の圧力が 400 で水素と酸素のモル比は 1:1とあるので、高圧側の H2 の圧力は 200 とわかります。
一方、低圧側は圧力の和が 100 なので、H2 の圧力は 100x と考えられます。従って、高圧側と低圧側の水素の圧力差は、ΔPH2 = 200ー100x です。
同様に、O2 のみに注目すると、高圧側と低圧側の酸素の圧力差は
ΔPO2 = 200ー{100(1-x)}= 100 + 100x と表すことができます。
ガス透過速度を決定するパラメータとして、A と l は気体の種類によって変化しないため、C に注目します。気体の種類によって変わるのは、分子量 M だけです。水素と酸素の分子量はそれぞれ 2、32 なので、√をとれば、√2 と 4√2 です。透過係数の式より、√Mは分子にあるので、水素に注目した時の透過係数 C は、酸素の透過係数 C の 4 倍になることがわかります。
従って、水素と酸素の透過速度の比は
4×(200ー100x): 100+100x と表すことができます。そして、これがそのままモル分率の比です。すなわち、x:1-x となるはずです。そこで
800-400x:100+100x = x:1-x を解くと
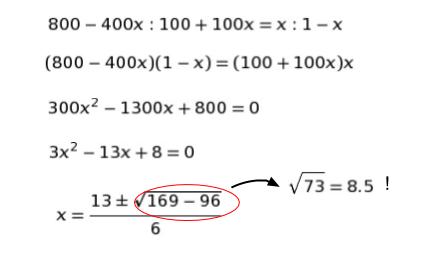
となります。
x < 1 より、±のマイナスの方で計算します。x = 4.5/6 = 0.75 です。
以上より、正解は 3 です。

コメント