問 題
炭酸カルシウムの解離反応
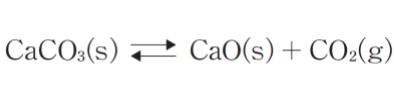
において、固相の活量を 1 とすると、この圧平衡定数 K は CO2 の平衡分圧 PCO2 となる(K = PCO2)。
この解離反応の 1000K 及び 1300K における CO2 の平衡分圧を測定したところ、それぞれ 5.87 × 103 Pa、5.41 × 106 Paであった。CO2 の平衡分圧が 1.00×105 Pa となる温度はおよそいくらか。
ただし、温度を T、圧平衡定数を K、反応エンタルピーを ΔH、気体定数を R とするとこれらには
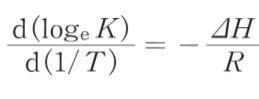
の関係が成り立つ。また、log105.87 = 0.768、log105.41 = 0.733とする。
1.1010K
2.1060K
3.1110K
4.1180K
5.1220K
解 説
CaCO3 ⇄ CaO + CO2 で、平衡分圧 = 圧平衡定数となる。とあるので、求めなければいけない「CO2 の平衡分圧が 1.00 × 105 Paとなる温度」は「圧平衡定数 K が1.00 × 105 となる温度」と読み替えることができます。
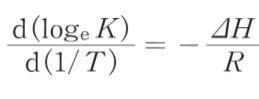
という式から、横軸が 1/T、縦軸が logeK のグラフを考えれば、傾きは右辺の、負の定数(ーΔH/R)ということが読み取れます。
 問題文で、1000K ,1300K の CO2 の平衡分圧 = 圧平衡定数 K がそれぞれ与えられているので、1/T,log10K も含めてまとめてみると、以下の表になります。
問題文で、1000K ,1300K の CO2 の平衡分圧 = 圧平衡定数 K がそれぞれ与えられているので、1/T,log10K も含めてまとめてみると、以下の表になります。

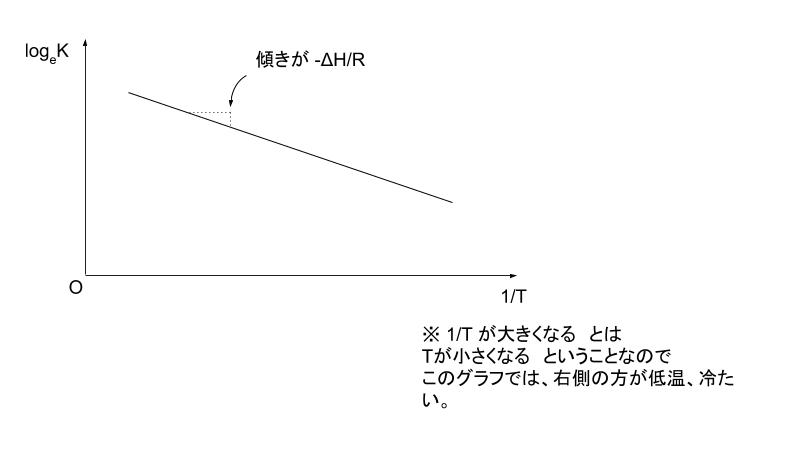
横軸を 1/T , 縦軸を log10K としたグラフを考えて、わかっている 2 点(T=1000,1300)を書き込むと以下のようになります。
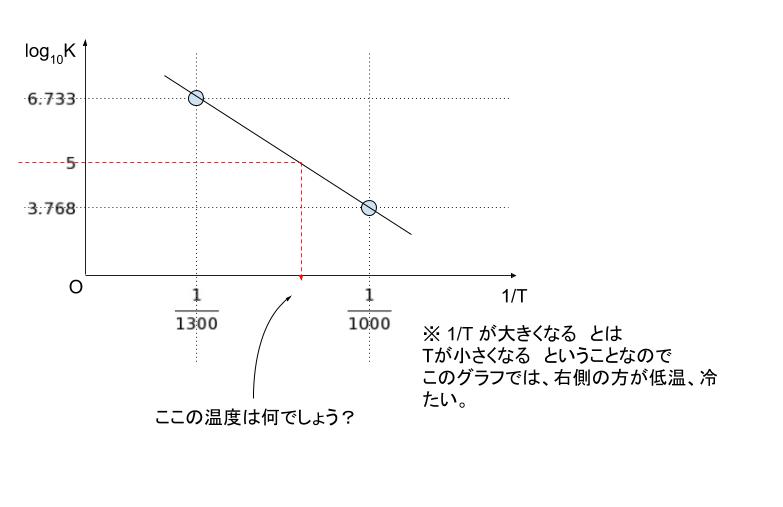 5 は、3.768 を下端、6.733 を上端とすれば、「3.768 寄り」なので、真ん中である 1/1150 よりもう少し右、つまり分母が1150 よりも小さくなると考えられます。選択肢から 一番近いのは1/1110 と考えられます。
5 は、3.768 を下端、6.733 を上端とすれば、「3.768 寄り」なので、真ん中である 1/1150 よりもう少し右、つまり分母が1150 よりも小さくなると考えられます。選択肢から 一番近いのは1/1110 と考えられます。
以上より、正解は 3 です。
ちなみにですが、途中で グラフの縦軸を logeK → log10K に変えています。logeK というのは、結局 log10K/2.3 ぐらいなので、縦軸を log10K にしても全ての 点の y 座標が 下に押し下げられるだけで、結局直線(つまり比例関係)になります。そのため、本問を解く際に影響はありません。

コメント