問 題
25°C 1気圧の下である気体中に含まれるホルムアルデヒドの量を測定する。まず,捕集管に気体を流速 1.0L/min で 30 分間流通し気体中のホルムアルデヒドを誘導体化して捕集した。
次に捕集したホルムアルデヒド誘導体をアセトニトリル 10mL で溶出し溶出液を分析したところ溶出液のホルムアルデヒド誘導体濃度は 2.0μmol/L であった。気体のホルムアルデヒド濃度(ppbv)はいくらか。
ただし捕集効率(捕集管を通過したホルムアルデヒドのうち捕集管に捕集される割合)は100%であり、1mol のホルムアルデヒドから 1mol のホルムアルデヒド誘導体が生成し誘導体化及び溶出における損失はないものとする。また 1ppbv は体積比で 10-9 の割合を占めることを表し、25°C 1気圧における気体 1mol の体積を 24.5L とする。
1. 130 ppbv
2. 64 ppbv
3. 32 ppbv
4. 16 ppbv
5. 8.0ppbv
解 説
問題文、及び操作(やったこと)のイメージが以下になります。
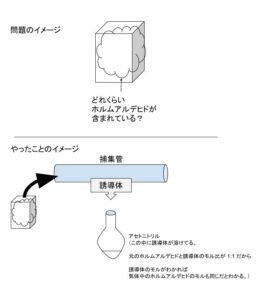
まず、捕集管を通した気体が 1.0L/min で、30 min なので、30 L とわかります。元の気体 30 Lに含まれるホルムアルデヒドは誘導体化されます。この時、モルは変わりません。そして、アセトニトリル 10 mL = 0.01 L に溶かしたら、濃度が 2.0 μmol/L です。
2.0 μmol/L とは、1 L 中に 2.0 μ mol ということだから、0.01 L 中なら、 0.02 μ mol です。0.02 μ mol は、20 n mol です。(これが、30 L の気体に含まれていたホルムアルデヒドのモルです。)気体に含まれていたホルムアルデヒドのモル数はわかったので正解を、選択肢から検討します。
気体は、大体 25 L で 1mol なので、30 L の気体 とは、 1.2 mol の気体です。選択肢から、答えは 10 ~ 100 ppbv なので、10 ppbv と仮定します。すると、ホルムアルデヒドの量は、1.2 × 10 × 10-9 = 12 n mol となります。実際のホルムアルデヒドは 20 n mol でした。10 ppbv だと 12 n mol なので、もう少し高い濃度です。
また、20 ppbv だと 24 n mol となるので、20 ppbv よりは低い濃度です。つまり、16 ppbv とわかります。
以上より、正解は 4 です。

コメント