問 題
溶液の pH を電位差によって測定するため図のような装置を作った。このとき電圧計で測定される電位差 E は、A をある定数として次式で表される。
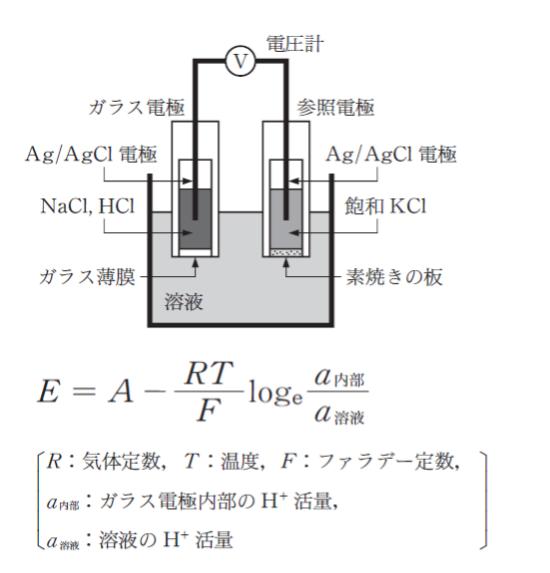
温度 298K の下で、pH 4.0 の標準緩衝液に両方の電極を浸したところ、電位差が 814 mV であった。同じ温度の下で溶液に両方の電極を浸したところ電位差が 843 mV であった。溶液の pH はいくらか。
ただし、R = 8.31J/(K・mol)、F = 9.65× 104 C/mol、loge10 = 2.30 とし、H+ の活量は H+の濃度に等しいものとする。
1. 1.7
2. 2.4
3. 3.5
4. 4.6
5. 5.8
解 説
いわゆる現場思考型の問題です。pH 4.0 の時と、pH 未知の場合でそれぞれ式に値をとりあえず代入してみて考えます。以下が、pH 4.0 の時です。いくつか近似をしている所に注意が必要です。また、a内部 というのはNaCl,HCl や、KCl であることから、中性なので pH = 7.0 → [H+]= 1.0 × 10-7 として代入しています。
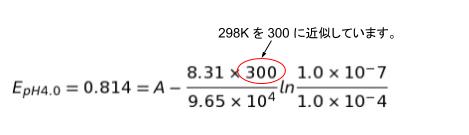
ここから A を求めることもできるのですが、求めたいのは、pH未知 なので先に、pH 未知の時の式を考え式変形によってA を消去します。(もちろん、Aを求めた上で計算しても、かまいません。)

分数の部分(左の赤丸で囲んだ部分)は、分子が ほぼ 2500, 分母は ほぼ 100000 です。よって、ほぼ 0.025 です。
また、ln の部分(右の赤丸で囲んだ部分)は引き算なので、中身の割り算(つまり、逆数のかけ算)となり、以下のように約分されます。
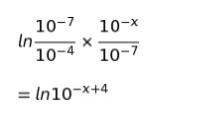
まとめると
0.03 = 0.025×(4-x)×ln10 です。ln10 ≒ 2.3 であることから、4-x が、大体 0.5 だとちょうどいいということがわかります。選択肢から、x = 3.5 です。
以上より、正解は 3 です。

コメント