問 題
水酸化ナトリウム炭酸ナトリウム及び塩化ナトリウムの混合物がある。この混合物を 2.00g 量り取って純水に溶かし全体を正確に 1.00L の水溶液にした後その水溶液を 20.0 mL 取り出し 1.00× 10-2 mol/L の希塩酸で滴定した。
まずフェノールフタレインを加えて滴定したところ希塩酸を 30.0 mL 加えたところでフェノールフタレインの色が完全に消えた。この溶液にメチルオレンジを加えて滴定を続けると希塩酸を更に 10.0 mL 加えたところでメチルオレンジが赤色になった。混合物中に含まれていた水酸化ナトリウムの含有率(重量%)はいくらか。
ただし NaOH の式量を 40、フェノールフタレインの変色域を pH 8.3~10.0、メチルオレンジの変色域を pH 3.1~4.4 とする。また炭酸の第一解離定数を K1、第二解離定数を K2 とすると,pK1 = 6.3 pK2 = 10.3である。
1. 10%
2. 20%
3. 40%
4. 50%
5. 60%
解 説
水酸化ナトリウム 及び 炭酸ナトリウム のHCl による中和が、指示液の変化として表れます。それぞれの中和の式を考えると、まず、水酸化ナトリウムの中和が、以下のように表されます。
NaOH + HCl → NaCl + H2O
炭酸ナトリウムは、二段階で中和が進みます。すなわち
1:Na2CO3 + HCl → NaHCO3 + NaCl
2:NaHCO3 + HCl → NaCl + H2O + CO2
塩酸によりフェノールフタレインの色が消えるまでは「水酸化ナトリウムの中和と炭酸ナトリウムの第一段階の中和」が進行し、以降の、メチルオレンジの色が変わるまでは「炭酸ナトリウムの第二段階の中和」が進行した と考えられます。イメージが、以下になります。
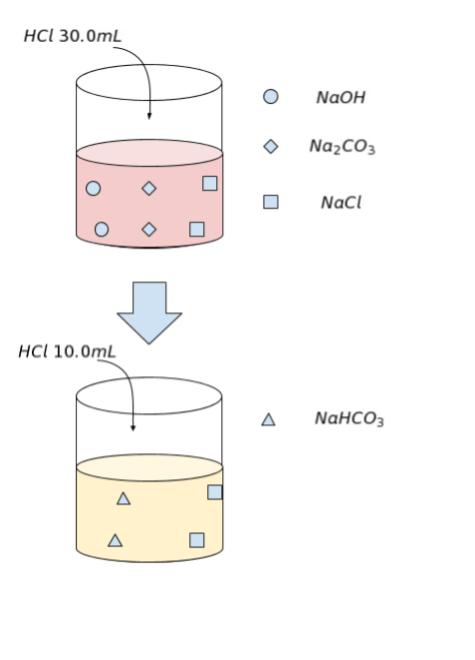
炭酸ナトリウムの第二段階の中和には塩酸 10.0 mL が用いられています。そして、化学反応式を見れば、Na2CO3、NaHCO3 の係数が全て1なので、炭酸ナトリウムの第一段階の中和で用いられた塩酸の量も 10.0 mL であることがわかります。よって、水酸化ナトリウムの中和に用いられた塩酸の量は 30.0 – 10.0 = 20.0 mL です。
濃度 1.00 × 10-2 mol/L の塩酸 20.0 mL ( = 0.02 L) で中和されたのだから水酸化ナトリウムは、1.00 × 10-2×0.02 = 2.0 × 10-4 mol 入っていました。単位を g になおすために、式量 40 をかけると、2.0 × 10-4 × 40 = 8 × 10-3 (g) です。
混合物を溶かして作った水溶液全体が 1L で、そこから20.0 mL 取り出した所、NaOH が 8 × 10-3 (g) 入っていたのだから、全体には、その 50 倍入っていたはずです。
8 × 10-3 × 50 = 4 × 10-1 = 0.4 g となります。混合物 2.0 g 中、0.4 g が NaOH なので含有率は 20 % となります。
以上より、正解は 2 です。

コメント