問 題
298K1気圧における気体の2-ブテンの、次の異性化反応を考える。
cis – 2 -ブテン ⇄ trans – 2 – ブテン
モル分率、化学ポテンシャル、標準化学ポテンシャルを cis – 2 – ブテンについてそれぞれ xc 、μc 、μc°とし、trans – 2 – ブテンについてそれぞれ xt, μt, μt°とする。また温度をT 気体定数をR とすると次の関係が成り立つ。
μc = μc°+ RT logexc
μt = μt°+ RT logext
ここで系全体を通してのギブズエネルギー g を次のとおりとすると g とxt の関係は図のように表される。
g = xcμc+ xtμt
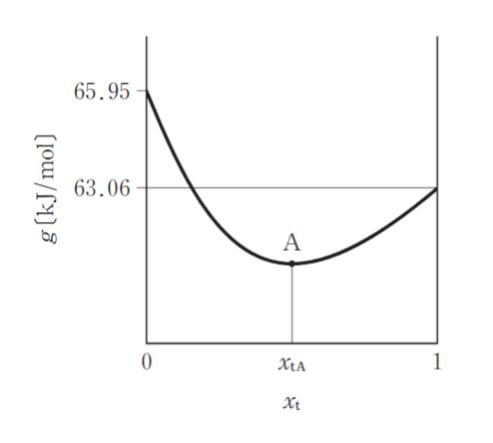
このとき, g が最小となる点 A における xtA はおよそいくらか。ただしμc°、μt° は純粋な cis -2-ブテン, trans – 2 – ブテン 1mol の標準生成ギブズエネルギーに等しく、それぞれ μc°= 65.95kJ/mol、μt°= 63.06kJ/mol であり R = 8.31J/(mol・K) 、 e1.17 = 3.22とする。
1. 0.32
2. 0.48
3. 0.68
4. 0.76
5. 0.82
解 説
解法1
この問題で問われているのは、最も安定な時 = 平衡状態 の cis – 2 ブテン と、 trans – 2 -ブテン の割合です。「平衡、自由エネルギー」と来れば、ΔG = RT ln K という公式を使います。選択肢からそんなに厳密な計算は不要なので、μc°= 66 kJ/mol、μt°= 63 kj/mol とします。すると、ΔG = 3 です。
さらに、R = 8.3 、T = 300 とします。RT は、大体 2500で、単位を kJ になおしてRT = 2.5 (kJ) とします。公式より 3 = 2.5 lnK です。従って、lnK が大体 1.2 です。ln K = 1.2 なら e1.2 = K です。e1.17 = 3.22 なので、K は、それよりちょっと大きいぐらいの値ということになります。
K = [trans]/[cis] なんだから、K = 3 であれば、trans :cis が 3 :1 です。それよりちょっと多いぐらいです。また、K は 4 よりは小さいと評価できるため、trans : cis は 4:1 よりは小さいと考えられます。つまり trans が 75 % よりちょっと多いぐらいで80 % よりは小さいと目処をつけることができます。
以上より、選択肢から探せば、正解は 4 です。
解法2
(試験では、こちらも使えるようになりたいところです。与えられた式で、なんとか正解を絞るやり方です。ただ、微分が少し計算複雑。数学きらいなら、この方法は軽く見るだけでいいです。深入りは避けてください。)
xt = 1 – xc
μc°= 66 kJ/mol
μt°= 63 kJ/mol
RT = 2.5 として、与えられた g = xcμc+ xtμtを変形すると

となります。
e1.17 = 3.22 より、e1.2 = 3.3 ぐらいと考えます。符号に注意します。1-xc/xc が、3.3 ぐらいなら、xc : 1-xc は1:3よりは大きく、1:4よりは小さいぐらいということです。xt、つまり 1-xc は 0.75 ~ 0.8 と絞れます。
以上より、選択肢から、正解は 4 です。

コメント