問 題
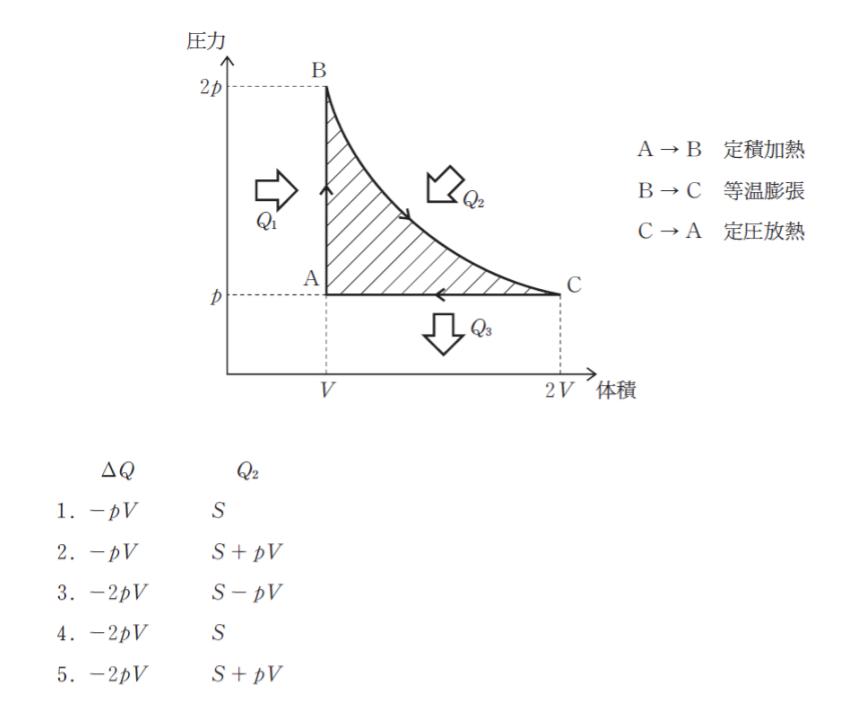
図のように一定量の理想気体を変化させるとき、ΔQ = Q1- Q3 及び Q2 の組合せとして最も妥当なのはどれか。
ただし、図の斜線部の面積を S とする。また定積加熱過程(状態A → B)において気体が受け取る熱量を Q1、 等温膨張過程(状態 B → C )において気体が受け取る熱量を Q2、定圧放熱過程(状態 C → A )において気体が放出する熱量を Q3 とする。
解 説
気体の仕事、熱 に関する基本公式は以下の 2 つです。「気体、熱、仕事」といった単語が複数問題文に出てきたら、思い出します。
基本公式1:W = pΔV
基本公式2:ΔU = W + Q
※ W は、work の頭文字。仕事を表します。
※ W は、気体が「外から受けた」仕事(例:ギューっと押される とか) です。そのため、気体が仕事をした場合は符号が負であることに注意です!
※ ΔU は、気体の持つ内部エネルギーの差です。
※ Q は、気体が外部から受け取る熱 です。
状態 A→B、B→C、C→A をそれぞれ検討してみます。
『 状態 A → B 』
「定積」とあるから ΔV = 0 。つまり、公式 W = pΔV より、W も 0 です。熱は受け取っており、気体の持つ内部エネルギーは変化します。その変化を ΔU とおくと ΔU = Q1 と表すことができます。
『 状態 B → C 』
等温膨張です。つまり、ΔU = 0 です。体積が V → 2V となっているため ΔV が存在する。つまり、W がある。言い換えると、気体が仕事したといえます。
どれくらい仕事したかというのは「PΔV を、V=V から、V = 2V まで積分」すればわかるのですがこれは、まさに P-V グラフにおいて「B→C の曲線と x 軸で囲まれた部分の面積を求める」 ということです。(ここは、覚えている人も多いと思います。「P-V グラフなら、面積が仕事」です。)
よって B → C の「気体が外部にした仕事」は、-(S+PV) と表すことができます。従って、 0 = -(S + PV) + Q2 ∴ Q2 = S + PV です。正解は、2 か 5 に絞られます。
『状態 C → A 』
「定圧」なので、P は一定です。この間の仕事は、PV です。従って、公式から ΔU = PV – Q3
※ 体積が 2V → V になっているため、外部から受ける仕事 となり、PV の符号は正にしています。
※ 図の中で Q3 が出て行く方向になっているため符号はマイナスにしています。
A→B の内部エネルギー変化が ΔU(A→B)
B→C は、内部エネルギー変化なし。
C→A の内部エネルギー変化が、ΔU(C→A)であり、結果として全く同じ状態である A に戻っていることから、ΔU(A→B)と、ΔU(C→A)は、合わせると 0 だったと考えられます。
よって
ΔU(A→B)+ΔU(C→A)
=Q1 + (PV - Q3) = 0
つまり、Q1 - Q3 = -PV です。
以上より、正解は 2 です。

コメント