問 題
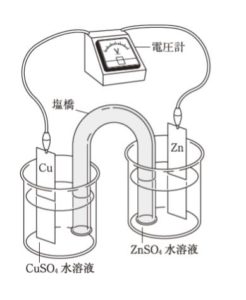
図のようなダニエル電池がある。次の操作 ㋐、㋑、㋒ のうちから電極間の電圧を大きくするもののみを全て選び出しているのはどれか。ただし、この電池の標準起電力は1.1 Vであり、操作を行う前の各水溶液中の金属イオンの活量a(Cu2+)とa(Zn2+)は等しいものとする。
㋐正極側の水溶液に水を加える。
㋑負極側の水溶液に水を加える。
㋒ZnSO4 水溶液に ZnSO4 の粉末を更に加える。
- ㋐
- ㋐㋒
- ㋑
- ㋑㋒
- ㋒
正解 (3)
解 説
ダニエル電池なので、負極が Zn 側です。こちらで Zn → Zn2+ + 2eー という反応がおきて亜鉛が溶けます。この結果として、ZnSO4 溶液がどんどん「濃く」なります。
ボルタ電池やダニエル電池は、しばらくすると使えなくなる電池です。(これは基礎知識)。従って「反応が進行していくことで、溶液の状態が電池にとって悪い方に変わっていく」と考えます。であれば、ZnSO4 を「できるだけ薄めに」用意しておけば電流はより流れるはずです。いいかえれば、溶液を薄めるということは起電力を大きくするような操作であると考えられます。
以上より、㋑は正しく、㋒が誤りです。
正解は 3 です。
ちなみに、正極である Cu 側に注目すれば、こちらでは Cu2+ + 2e– → Cu となり、銅板に銅が付着していきます。ということは CuSO4 溶液はどんどん「薄く」なります。よって、CuSO4 溶液側は「濃くする操作」によって起電力が大きくなると考えられます。水を加えると薄くなってしまうから、㋐ は誤りです。

コメント