問 題
酸素濃度が22~27体積%の範囲の酸素富化空気により、乾き排ガス中CO2濃度が12.6体積%となる空気比で完全燃焼させたとき、湿り排ガス中H2O濃度が4.71体積%となる燃料はどれか。
- C4H10
- C3H8:20体積%、C4H10:80体積%の混合燃料
- C5H12
- C:85.5質量%、H:14.0質量%、S:0.4質量%、N:0.1質量%の組成の液体燃料
- C:79.5質量%、H:5.2質量%、O:6.3質量%、S:0.5質量%、N:0.5質量%、灰分8.0質量%の組成の乾燥石炭
解 説
本問では、選択肢にはSやNや灰分が登場しますが、問題文ではこれらの情報が一切ありません。また、問題文で与えられている酸素濃度も22~27%とはっきりしないため、これら曖昧な情報は一旦置いておき、数値のはっきりしているところからアプローチしていくのがセオリーです。
数値が確定しているのは、「乾き排ガス中CO2濃度が12.6体積%」と「湿り排ガス中H2O濃度が4.71体積%」の2つです。完全燃焼という条件下なので、これだけの情報量があれば、燃料中のCとHの比を求めることができます。
まず、2つの数値は「乾き」と「湿り」で条件が異なっているので、これを揃えようと思います。
「湿り排ガス中H2O濃度が4.71体積%」から、湿り排ガス中のH2O以外の成分は次のように計算できます。

ここで、「湿り排ガス中のH2O以外の成分」というのは、つまり「乾き排ガス中の全ての成分」のことです。そして、乾き排ガス中の全てを100%としたときのCO2濃度が12.6%なので、湿り排ガス中のCO2濃度は次のように計算できます。

これで「湿り排ガス中」という同じ条件下でH2OとCO2の濃度(体積)を比較することができます。
![]()
当面の目標は燃料中のCとHの比を求めることですが、(3)式で「(CO2体積):(H2O体積)」がわかっています。CO2にはCが1原子、H2OにはHが2原子含まれているので、「(C体積):(H体積)」は次のようになります。
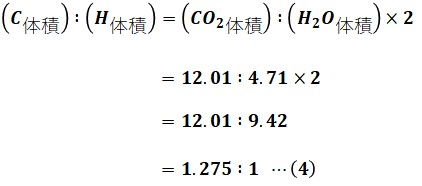
以上から、CとHの体積比は1.275:1だとわかりました。つまり、燃料に含まれるC原子とH原子の数を比較したとき、CはHの1.275倍あることになります。
ここで選択肢(1)~(3)を見ると、いずれも明らかにCの数よりもHの数のほうが多いことがわかります。選択肢(2)についても計算するまでもありません。よって、選択肢(1)~(3)はこの燃料として不適切であると判断することができます。
一方、選択肢(4)と(5)は質量%で表示されているので、体積%のままでは判断できません。そこで、(4)式の結果を使って、以下のように体積%を質量%に変換します。

よって、CとHの質量比は15.3:1だとわかりました。
ここで、選択肢(4)は「C:85.5質量%、H:14.0質量%」なので、その比は6.11:1です。また、選択肢(5)は「C:79.5質量%、H:5.2質量%」なので、その比は15.3:1となり、これは(5)式の計算結果と一致します。
以上から、正解は選択肢(5)となります。

コメント
正直、これはきちんと計算せずとも
CとHのモル比の規模感ですぐに出ますね…
湿りガス乾きガスとかも気にしなくて解けます
近い規模感の物が出たら真面目に計算すべきであって、まずはCとHのモル比で絶対違うものは削除するのが大事ですね