問 題
試料燃焼排ガスを通過させた吸収液を、容量250mLの全量フラスコに移し希釈した後、イオンクロマトグラフで硫酸イオン濃度を分析して以下の結果を得た。
乾き燃焼排ガス中のSOxの体積濃度(ppm)は、およそいくらか。
- 硫酸イオン濃度:0.051mg/mL
- 空試験で求めた硫酸イオン濃度:0.001mg/mL
- 標準状態に換算した乾き試料ガス採取量:9.70L
- 200
- 250
- 300
- 350
- 400
解 説
まず、求めたいのはSOxの体積濃度[ppm]です。すでに乾き試料ガス採取量が標準状態換算で9.7[L]であるとわかっているので、標準状態でのSOxの体積がわかれば、その比を求めることで答えが出ます。
ここで、問題文で与えられている条件は、SOxではなく硫酸イオン(SO42-)に関する数値です。しかし、SOxとSO42-はどちらもS(硫黄)1つ分なので、これらの物質量(モル数)[mol]は同じ値となります。
そのため、SO42-のモル数がわかれば、それがそのままSOxのモル数[mol]であり、これに22.4[L/mol]を掛けた値がSOxの体積(標準状態換算)[L]となります(標準状態において、気体は種類によらず1[mol]あたりの体積が22.4[L]です)。
よって、条件として与えられているSO42-のモル数を算出することが最初の目標となります。
まず、SO42-濃度は0.051[mg/mL]ですが、空試験で検出した分を引いたのが真の値となるため、0.001を引いて0.050[mg/mL]となります。これに容量250[mL]を掛けると、SO42-の質量を求めることができます。
![]()
SO42-の分子量は32×1+16×4=96なので、(1)式と合わせるとモル数が計算できます。電卓で小数点以下を求めても構いませんし、下記のように分数のままでも構いません。
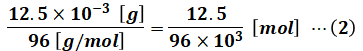
(2)はSO42-のモル数として求められた値ですが、上記の通りSOxとSO42-のモル数は等しいので、(2)の値はSOxのモル数ともいえます。よって、標準状態では気体の体積が1[mol]あたり22.4[L]であることから、SOxの体積(標準状態換算)は以下のように計算できます。
![]()
これでSOxの体積がわかったので、(3)式の結果を乾き試料ガス採取量(標準状態換算)=9.7[L]で割れば、SOxと試料ガスの体積比(体積濃度)として表すことができます。
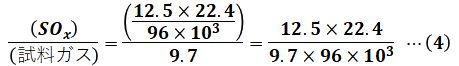
最後に、答えの単位が[ppm]になっているので、これに合わせる必要があります。ppmはparts per millionの略で、百万分率のことです。よって、(4)式の計算結果に「×106」をすることで、比の値を[ppm]で表すことができます。
![]()
以上より、正解は(3)となります。

コメント