問 題
組成が炭素85%、水素15%である軽油10kg/hとメタン30m3N/hを混焼するバーナーで完全燃焼させたとき、乾き燃焼排ガス中のCO2濃度は10.5%であった。
このときのバーナー全体の空気比は、およそいくらか。
- 1.12
- 1.15
- 1.18
- 1.21
- 1.24
解 説
本問では軽油とメタンを完全燃焼させているので、まずはこれらの反応で消費する物質と生成する物質について考えます。
問題文によると軽油は全部で10kg(=10000g)あり、そのうち炭素分が85%、水素分が15%です。炭素と水素の原子量はそれぞれ12、1なので、軽油の燃焼に伴う炭素・水素の化学反応式と、反応前後に存在するそれぞれの物質量 [mol] は次のようになります。この時点では話を簡単にするため、空気比については考えません。
- 炭素分
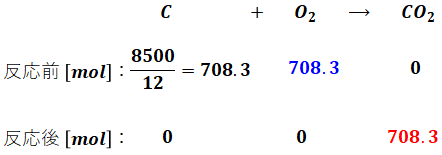
- 水素分
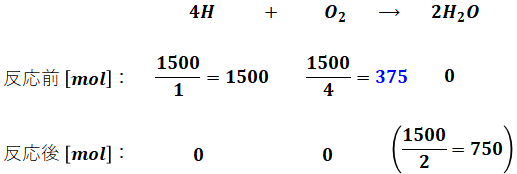
また、メタン30m3N(=30000L)あり、気体の場合は標準状態22.4Lで1molなので、その物質収支は次のようになります。
- メタン分

以上から、これらの軽油とメタンを完全燃焼させたときに消費する酸素(上記の青数字)と生成する二酸化炭素(上記の赤数字)は次の通りです。
![]()
![]()
消費する酸素量がわかったので、ここから理論空気量を計算することができます。空気中の成分のうち酸素の割合は21%なので、理論空気量は(1)式を使って次のように算出できます。
![]()
よって、(1)式と(3)式から、理論空気量のうち窒素の分は、(4)式のようになります。
![]()
ここで、問題文では二酸化炭素が10.5%とあります。燃焼反応後に残っているのは(2)式の二酸化炭素と、(4)式の理論空気量の窒素分と、過剰空気の3つなので、以下の(5)式のような関係式が成り立ちます。

過剰空気をaとしたとき、(5)式に(2)式と(4)式を代入してaについて解くと、次のようになります。
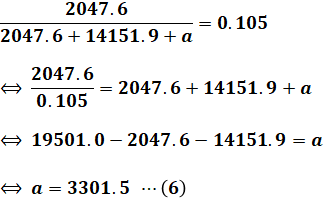
以上で空気比を求めるための準備が整ったので、最後に空気比を計算します。

よって、正解は(3)となります。

コメント