問 題
炭素71%、水素4.8%、酸素9%、窒素1%、硫黄0.2%、灰分10%、水分4%の組成の石炭を完全燃焼させたとき、乾き燃焼ガス中の酸素濃度が4.0%となる空気比は、およそいくらか。
- 1.18
- 1.23
- 1.28
- 1.33
- 1.38
解 説
石炭の成分がたくさん書かれていますが、このうち灰分と水分は気にしなくて大丈夫です。
というのも、灰分は燃やしてもガス化しない(=燃えない)ので、燃焼前後のガス成分に影響しません。また、水分は水蒸気に変わるものの、今回は乾き燃焼ガスの話をしているので無視することができます。
そのため、残る炭素、水素、酸素、窒素、硫黄の燃焼について考えることになります。
以下では仮に石炭が100[g]、反応前の空気中の酸素分子がA[mol]だけあるものとして考えます。この値は適当に決めたものなので、別の数値に置き換えても構いません。結局は比の計算になるので、どのように設定しても同じ答えが得られます。
石炭を100[g]としたとき、炭素(C)は71[g]、水素(H)は4.8[g]、酸素(O)は9[g]、窒素(N)は1[g]、硫黄(S)は0.2[g]であり、各成分は完全燃焼によって以下のようになります。
- C:燃焼によってCO2が生成する
- H:燃焼によってH2Oが生成する(乾き燃焼ガスとしてはノーカウント)
- O:燃焼によってCO2やH2O、SO2の構成成分となる(足りない分は空気中の酸素を消費)
- N:燃焼によってN2が生成する(NOやNO2にはならず、酸素は消費しない)
- S:燃焼によってSO2が生成する
以上から、完全燃焼の化学反応式は次のように書くことができます。なお、それぞれの原子量はC:12、H:1、O:16、N:14、S:32です。
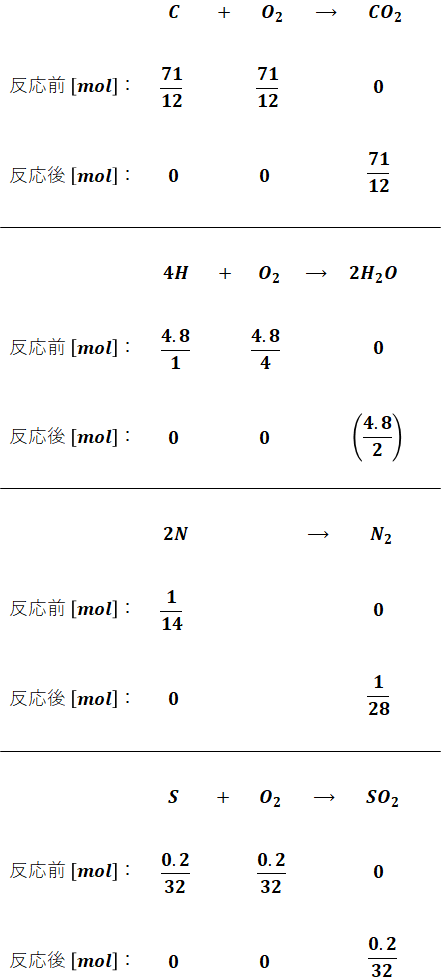
上図から、完全燃焼によって発生したガスは次のように算出できます。ただし、問題文で乾き燃焼ガスで考えることが指定されているので、水素を燃焼して生じた水蒸気については計算に入れません。
![]()
一方、消費した酸素(O2)は以下のように計算することができます。
![]()
(2)式の消費O2のうち、9[g]分は石炭由来の酸素が使われます。よって、消費O2のうち空気由来のO2は次のように表されます。
![]()
ここで、完全燃焼後の乾き燃焼ガス中の酸素濃度が4.0%とのことですが、完全燃焼後の乾きガス成分は次のようなものがあります。
- 完全燃焼で生じたガス
- 使わなかった(余った)分の酸素
- 酸素以外の空気成分(窒素)
1.に関しては(1)式の通りで、5.959[mol]です。
2.に関して、最初に空気中のO2がA[mol]あったと仮定して、(3)式の通り燃焼に6.842[mol]使っているので、![]()
となります。
3.に関しては、空気中の酸素濃度は21%、窒素濃度は79%なので、O2がA[mol]のときには窒素は![]()
と計算できます。
以上の3つの数値の和が乾き燃焼ガスの総量で、その酸素濃度が4.0%ということは、以下の等式が成り立ちます。
![]()
(6)式を解けば、反応前に存在する酸素分子A[mol]が算出されます。
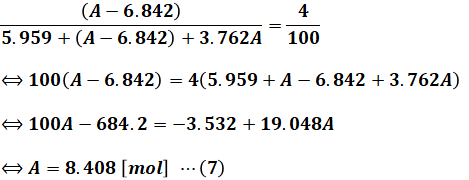
よって、(7)式より空気中の酸素はもともとは8.408[mol]あって、(3)式よりそのうち6.842[mol]が燃焼に使われたので、その空気比は次のように計算できます。
![]()
以上から、正解は(2)となります。
ちなみに、有効数字の取り方によっては上記とは多少異なった計算結果が出るかもしれません。それでも余りにも雑な端数処理をしない限りは選択肢から正解が選べるはずなので、計算結果が1.22とか1.24になったとしても、気にせず選択肢(2)を選んでよいと思います。

コメント