炭素89質量%、水素11質量%の組成の液体燃料Aと炭素88質量%、水素10質量%、硫黄2質量%の組成の液体燃料Bを混合して、空気比1.2で完全燃焼させた。このとき、乾き燃焼ガス中のSO2が456ppmとなる、燃料Aと燃料Bの質量混合比(A:B)はどれか。ただし、硫黄分は燃焼によりすべてSO2になるとする。
- 1:1
- 3:2
- 2:1
- 3:1
- 4:1
解 説
燃料Aと燃料Bの質量混合比を求める問題なので、ここでは燃料Aが100aと燃料Bが100bあると仮定します(100aとしているのは、89%と11%に分けたときに分数にならないようにするためです。こうすると計算の煩雑化を少しだけ軽くできますが、100倍せず普通にaとbで計算を進めても構いません)。
燃料Aは100aのうち89aが炭素で11aが水素なので、燃焼の結果は以下の通りです。
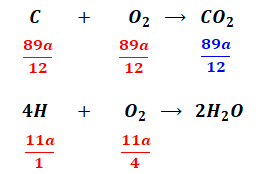
赤字の数字は消費したモル数、青字の数字は生成したモル数だと考えてください。また、H2Oにはモル数を記載していませんが、これは問題文に「乾き燃焼ガス」とあるため、水分量を考える必要がないからです。
同様に燃料Bについても考えると、燃焼の結果は以下のようになります。
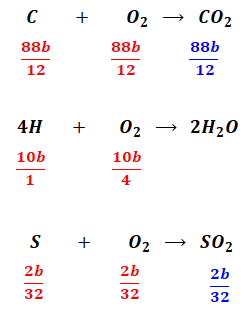
以上より、消費した酸素の量は
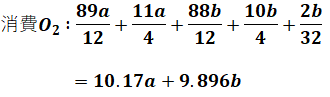
となります。小数点以下を何桁まで計算したかによって計算結果が多少変わるかもしれませんが、選択問題なので、あまり厳密に考えなくても大丈夫だと思います。
完全燃焼で消費する酸素量がわかり、空気比が1.2と与えられているため、初期状態の全酸素量は、
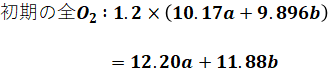
となり、燃焼後に余っている酸素量は、

となります。また、空気中の窒素は燃焼には関わらないため、初期の全窒素量がそのまま燃焼後にも残っています。空気中の酸素は21%、窒素は79%なので、窒素量は次のように計算することができます。

以上から、燃焼後に存在する窒素、酸素、二酸化炭素、二酸化硫黄の全てをaまたはbを使った文字式で表すことができました。これら全ての合計量に対する二酸化硫黄の割合が456ppm(=456×10-6)なので、これを式にすると以下のようになります。
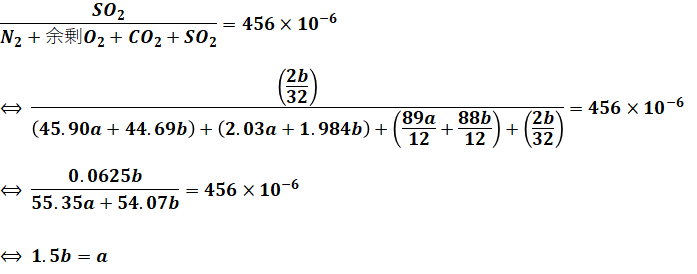
よって、aはbの1.5倍であることがわかるので、
![]()
となります。

コメント