問 題
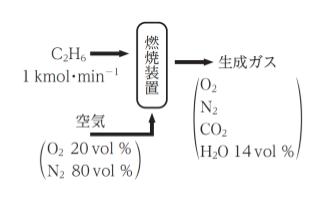
図のように、気体燃料のエタンを毎分 1.0 kmol 送り出し、それにある量の空気を混ぜ合わせて完全燃焼させている。このとき、エタンが全て反応し、生成ガスに含まれる水蒸気の割合が 14vol %であったとすると、1分当たりの空気の供給量及び酸素の過剰率

の組合せとして最も妥当なのはどれか。
ただし、空気の組成は、酸素 20vol %、窒素 80vol %とし、全ての気体は理想気体の挙動を示すものとする。
空気の供給量 酸素の過剰率
1.20kmol・min-1 14%
2.20kmol・min-1 20%
3.25kmol・min-1 43%
4.30kmol・min-1 20%
5.30kmol・min-1 71%
解 説
「完全燃焼」とあるので、生成物が CO2 と H2O のみです。
化学反応式は、C2H6 + 7/2O2 → 2CO2 + 3H2O です。
※係数の求め方は、エタンの化学式から「右辺の 2,3 が確定」し、それにより O の数が決まるため 7/2 という順番で求めます。
エタン 1kmol/分 が全て反応するのだから化学反応式の係数の比より、CO2 2kmol/分、H2O 3kmol/分 生成されています。ちなみに合計は 5kmol/分です。
このうちの H2O 3kmol/分 が 14% ということなので気体の全量は大体 21kmol/分です。※14% ≒ 1/7 なので、全体を求めるには 7 倍すればよい。
選択肢から検討すれば、もし空気 30kmol/分 だと反応しない N2 が80% = 24kmol/分 なので多すぎです。選択肢 4,5 は誤りです。
空気 25kmol/分 だとしても、N2 が 20kmol/分 なので、エタンからできる分をふまえれば多すぎです。選択肢 3 も誤りです。正解は 1 or 2 です。
そこで、空気 20kmol/ 分と仮定します。
供給される O2 は 4kmol/分です。エタン 1kmol で、O2の係数が 7/2 = 3.5 なので、「O2 は 0.5kmol/分 反応せずに余る」ということがわかります。理論必要量が 3.5 なので過剰率は、0.5/3.5 = 1/7 ≒ 14% です。
以上より、正解は 1 です。

コメント