問 題
気相反応 2HI ⇄ H2+ I2 を体積 V0 の容器を用いて次の方法 A,B で行った。
方法A: 初めにHI 1.0molのみを容器に入れ平衡に達するまで一定温度 T に保つ。
方法B: 初めに H2 1.0mol と I2 1.0molのみを容器に入れ平衡に達するまで T に保つ。
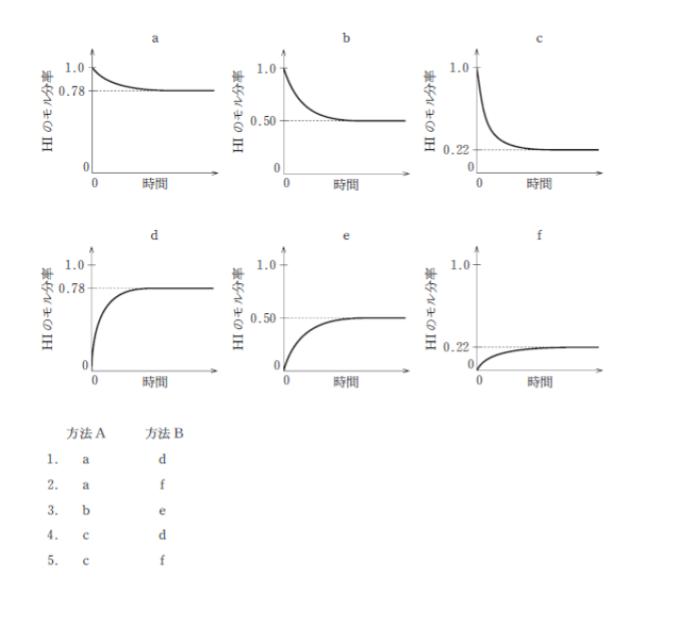
T における圧平衡定数 Kp が 2.0× 10-2 であるとき HI のモル分率の変化の様子を表した図を、方法 A については図の a b c から、方法 B では図の d e f からそれぞれ選び出したものの組合せとして最も妥当なのはどれか。ただし √2 = 1.4 とする。
解 説
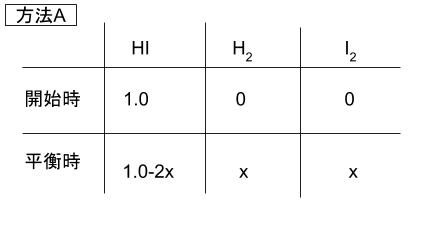
化学反応式の係数の和が左辺、右辺等しいため、圧平衡定数=平衡定数です。従って物質量の比を考えればOKです。反応開始時と平衡時の物質量について表を考えます。まず方法 A についてです。
平衡時に HI がどうなるかがわかればよいので、1.0-2x を改めて X とおきます。x = (1.0 – X)/2 と書き直し、表を書き直すと、以下のようになります。
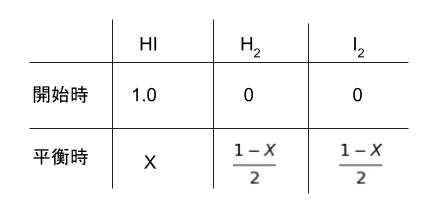
K = [H2][I2]/[HI]2 です。K が 2.0×10-2 なので表の式を代入して考えると
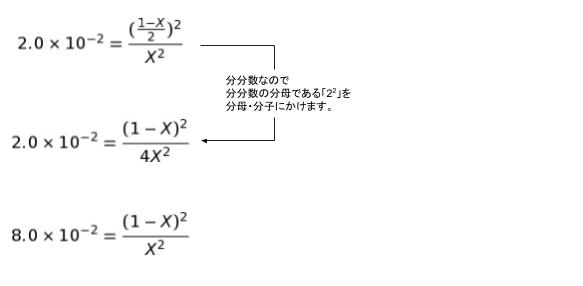
この式を厳密に解く必要はなく、選択肢から X が 0.78 か 0.50 か 0.22 かがわかればOKです。さらに 0.78 ≒ 0.75、0.22 ≒ 0.25 と考えて概算するとより簡単です。
1-0.75 = 0.25
1-0.50 = 0.50
1-0.25 = 0.75 なので、右辺の概算は、それぞれ
(0.25)2/(0.75)2 = (1/3)2
(0.5)2/(0.52) = 1
(0.75)2/(0.25)2 = 32 です。
左辺は 0.08 なので、一番近いのは X = 0.78 とわかります。(計算は 0.75 で近似したものです)。よって、方法 A について正しいグラフは a です。正解は 1 or 2 です。
方法 B についても同様に考えます。
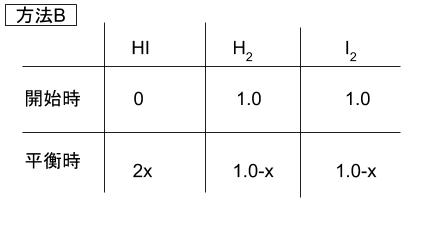
求めたい HI のモル分率とは、平衡時の物質量を全部足すと 2.0 なので、2x/2.0 = x です。結局 x がそのまま求めたいモル分率となります。K = [H2][I2]/[HI]2に表の式を代入して、方法 1 と同様に考えると
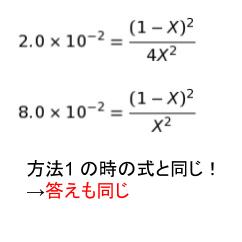
となります。よって、方法 B について正しいグラフは d です。
以上より、正解は 1 です。

コメント