問 題
反応速度に関する次の記述の ㋐、㋑ に当てはまるものの組合せとして最も妥当なのはどれか。
「物質 A から物質 B が生成する反応は次のように進行する。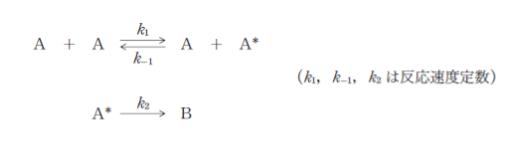
ここで A* は、A から生じる活性な中間体である。A* について定常状態近似が適用できるとすると、B の生成速度 r は r = ㋐と表すことができる。ここで [A] は A の濃度である。k-1[A] ㋑ k2 のとき、r は [A] の一次式で表すことができる。」

解 説
「A*について定常状態近似ができる」という記述があるので、A* の生成速度を式から立ててみます。A→B で反応速度 k ならば B の生成速度は k[A] と表されます。従って、A+A→A* に注目すれば k1[A]2 ・・・(1)です。一方、逆反応 A+A* → A+Aで A* は減ります。よって、k-1[A][A]* ・・・(2)で減ります。さらに、A*→B の反応でも減るので k2[A]* ・・・(3)で減ります。
(1)~(3)をまとめれば、A* の反応速度は k1[A]2 ー k-1[A][A]*ーk2[A]* となります。定常状態である というのは「変化してない状態」ということです。よって、反応速度の合計が0と考えられます。k1[A]2 ー k-1[A][A]*ーk2[A]* = 0 ・・・(4)と表せます。
B の生成速度は、k2[A]* です。選択肢を見ると [A]* を使わずに表せばいいと考えられるため(4)の式を [A]* = ・・・に直して代入してみます。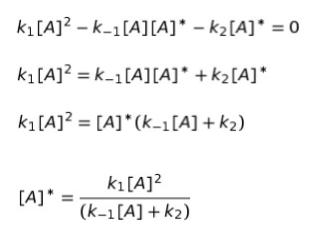
従って、B の生成速度 k2[A]* は、k1k2[A]2/(k-1[A]+k2) と表すことができます。正解は 4 or 5です。
k2 が無視できるくらい小さければ、B の生成速度は k1k2[A]2/(k-1[A]) となり、[A]を約分して [A] の一次式として表すことができます。よって ㋑ は >> です。
以上より、正解は 4 です。

コメント