問 題
塩素による酸化に関する記述として、誤っているものはどれか。
- 塩素を溶かした水のpHが上昇すると、水中のCl2は減少する。
- 塩素を溶かした水のpHが9.5以上では、HClOはほとんど存在しない。
- 塩素剤の酸化力は、主としてHClOによるものと考えられている。
- 遊離塩素には、Cl2、HClO及びClO-が含まれる。
- アンモニアを含む水に塩素を入れていくと残留塩素は次第に増加するが、不連続点(break point)と呼ばれる点から急に減少し始める。
正解 (5)
解 説
(1)は正しいです。塩素を水に溶かすと、以下の平衡反応が起こります。
![]()
pHが上昇するということは、上式右辺のプロトン(H+)が少なくなるということなので、それを補おうとして平衡は右側に移動し、その結果、Cl2の濃度が減少します。
(2)も正しいです。(1)の解説で示した通り、塩素を水に溶かすと次亜塩素酸(HClO)が生成しますが、これはpHによって分子の形をとったりイオンの形をとったりします。
![]()
pHが9.5以上の条件では、プロトン(H+)がなくなるので平衡の矢印は右側に傾き、次亜塩素酸は分子の形(HClO)からイオンの形(ClO-)へと変化します。
(3)も正しいです。HClOは強い酸化剤である一方、ClO-は酸化力を持つものの、かなり弱いです。そのため、塩素剤の酸化力は、主としてHClOによるものといえます。
(4)も正しいです。(1)と(2)の解説で示した化学反応式からもわかるように、遊離塩素にはCl2、HClO、ClO-の3つの形態があります。
(5)が誤りです。アンモニアを含む排水に塩素を注入したときの残留塩素濃度の変化は、下図のようになります。
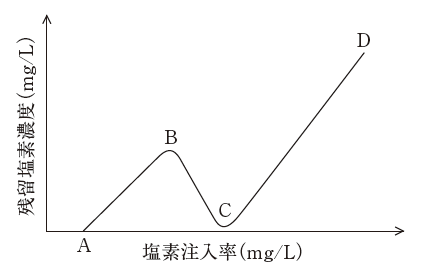
- 点Aから点Bの間では、水中のアンモニアと塩素が結合し、モノクロロアミン、ジクロロアミンなどのクロロアミンが生じています。
- 極大点Bから点Cの間では、結合塩素どうしが反応して結合塩素が減っていきます。
- 極小点Cは不連続点と呼ばれ、ここまでに注入された塩素量を塩素要求量と呼びます。
- 点Cよりさらに塩素を注入すると、遊離塩素が増加します。
よって、(5)の文章は不適切であり、たとえば「アンモニアを含む水に塩素を入れていくと残留塩素は次第に増加し、その後減少するが、不連続点(break point)と呼ばれる点から再び増加し始める。」のような文章にすると正しくなります。
以上から、正解は(5)です。

コメント