炭素87%、水素13%の組成の灯油0.7kgに水0.3kgを混合したエマルション燃料を空気比1.20で完全燃焼させる。エマルション燃料1kg当たり発生する湿り燃焼排ガス量(m3N)は、およそいくらか。
- 9.1
- 9.4
- 9.7
- 10.0
- 10.3
正解 (5)
問題文によると灯油は全部で700gあり、そのうち炭素分が87%、水素分が13%です。炭素と水素の原子量はそれぞれ12、1なので、灯油の燃焼に伴う炭素・水素の化学反応式と、反応前後に存在するそれぞれの物質量[mol]は、次のようになります。この時点では話を簡単にするため、空気比については考えません。
- 炭素分
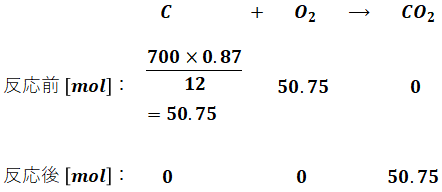
- 水素分
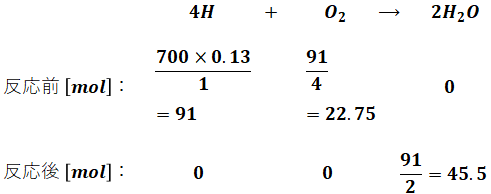
また、300gの水は、熱したらそのまま300gの水蒸気となります。水の分子量は18なので、物質量[mol]は次のように計算できます。
![]()
続いて、空気比を考慮に入れた計算について考えていきます。
まず、この燃料の完全燃焼で使用する酸素は、上記で計算した2つの数値の和となります。
![]()
よって、空気比が1.20のとき、最初に存在した酸素の量は次の通りです。
![]()
空気中の成分のうち酸素の割合は21%なので、上記とこの比から、反応前に存在していた空気の量は次のように計算できます。
![]()
最初420molあった空気のうち、73.5molの酸素が反応に使われるので、残った空気量は次の通りです。
![]()
以上で答えを出すのに必要な数値が全て出揃いました。問われているのは湿り燃焼排ガス量なので、完全燃焼の反応後に残っているガスの量を全て足していきます。
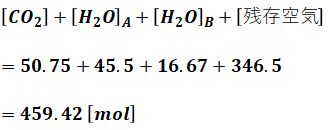
仕上げに、物質量[mol]を体積[m3N]に直します。1molの気体の体積は22.4Lであり、1000L=1m3Nである点に注意してください。
![]()

コメント