炭素86.0%、水素13.5%、硫黄0.5%の重油を13.5m3N/kgの空気で完全燃焼させた。乾き燃焼ガス中のSO2濃度(ppm)はおよそいくらか。ただし、重油中の硫黄分はすべてSO2になるものとする。
- 175
- 225
- 275
- 325
- 375
正解 (3)
解 説
「重油を13.5m3N/kgの空気で完全燃焼させた」と問題文にあるので、重油を1kg使うとして計算を進めてみます。
重油1kgで空気を13.5m3N使いますが、これはリットルに直すと13500Lになります。そのときの物質量は、1molあたり22.4Lなので、
![]()
となります。ここで、そのうちの21%が酸素で、残り79%が酸素以外の空気(ほとんど窒素)です。つまり、それぞれの物質量は次の通りです。
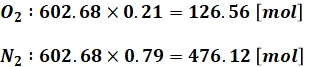
一方、重油1kgには問題文より、炭素が860g、水素が135g、硫黄が5g含まれるので、それぞれの物質量は以下のようになります。
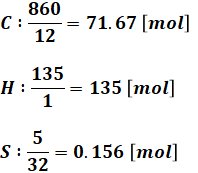
続いて、C、H、Sをそれぞれ燃焼させる反応式と、消費するO2、生成するガスの物質量を示します。
![]()
Cが71.67molなので、消費するO2も生成するCO2も71.67molとなります。
![]()
Hが135molなので、消費するO2は4で割って33.75molです(生成するH2Oは67.5molですが、乾き燃焼ガスでは考えなくてよいです)。
![]()
Sが0.156molなので、消費するO2も生成するSO2も0.156molとなります。
以上から、完全燃焼後に存在するガスの種類と物質量は以下の通りとなります。
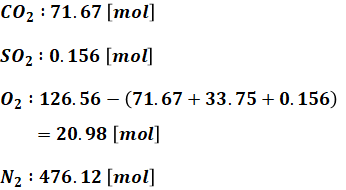
よって、最終的なSO2濃度は、
![]()
となります。設問はppmで聞いているため、0.000274を106倍すると、274ppmとなり、最も近い選択肢(3)が正解となります。

コメント