問 題
ある燃料を完全燃焼させたとき、湿り燃焼排ガス中及び乾き燃焼排ガス中のCO2濃度がそれぞれ8.93%、10.31%となった。この燃料の可燃分中のHとCのモル比(H/C)の値は、およそいくらか。ただし、燃料と燃焼用空気は水分を含まないものとする。
- 1.0
- 1.5
- 2.0
- 2.5
- 3.0
解 説
ある燃料というのが何だかわかりませんが、問題文から炭素と水素は必ず含んでいます。おそらく、その他のものも含んでいそうです。
まず、この燃焼を完全燃焼したあとに残る排ガスを考えると、次の4つに分類できます。
- 燃料中のC由来のCO2
- 燃料中のH由来のH2O
- 燃料由来のその他のガス
- 燃焼用空気由来のN2と残存O2
上記の1と2について、炭素と水素の燃焼式は以下のようになるので、完全燃焼によってCO2とH2Oが生成します。
![]()
![]()
上記の3について、問題文には「燃料の成分はCとHのみ」とは書かれていないため、窒素(N)や硫黄(S)などの他成分が含まれていると考えられますが、問題文に記載のないものは深く考えなくて大丈夫です。
上記の4について、燃焼後のガスには空気由来のN2や余ったO2が含まれているはずですが、問われているのはHとCのモル比なので、NやOの量は影響しません。
よって、上記3, 4はどちらもHとCのモル比に関係ない量なので、燃焼後の排ガスは「CO2・H2O・その他」の3種類に大別することができます。
以上を踏まえて、湿り燃焼排ガス中と乾き燃焼排ガス中のCO2の割合をそれぞれ数式で示すと、次のように表すことができます。両者の違いは、水分(H2O)をカウントするかしないかということです。
なお、下式において、「CO2・H2O・その他」のそれぞれのmol数を、(CO2)、(H2O)、(others)のように表します。
湿り燃焼排ガスのCO2の割合
![]()
乾き燃焼排ガスのCO2の割合
![]()
ここで、最終的に求めたいのは燃料のHとCのモル比(H/C)の値なので、上式の(others)は明らかに邪魔なパラメータです。これを消したいので、(4)式の両辺の分母・分子を入れ替えて、以下のように式変形します。
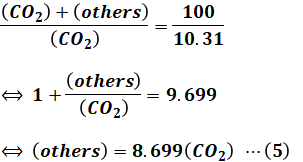
続いて、(5)式を(3)式に代入します。
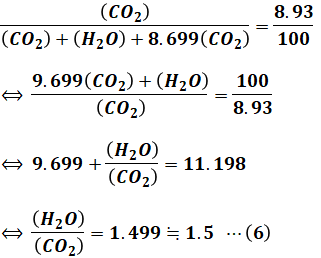
以上のように計算することで、生成するH2OとCO2のmol比を求めることができました。ただし、まだ答えではないので注意してください。今わかったのはH2O/CO2比であり、求めたいのは燃料中のH/C比です。
ここで、炭素と水素の燃焼式を下記に示します。これは、解説の最初のほうで示した(1)式と(2)式を再び載せています。
![]()
![]()
(1)式と(2)式を係数に注意しながら見ると、生成するCO2が1molなら燃料のCもそのまま1molであり、生成するH2Oが1molなら燃料のHはその倍の2molになることがわかります。
このことと(6)式を合わせることで、以下のように燃料中のH/C比を求めることができます。
![]()
以上から、正解は(5)となります。

コメント