NO3–の1molを生物的に脱窒素するために、水素供与体として理論的に必要なメタノールのmol数として、正しいものはどれか。
- 1/3
- 1/2
- 2/3
- 5/6
- 1
正解 (4)
解 説
脱窒素は嫌気処理の反応なので、メタノールは次の化学反応式により二酸化炭素に変わります。
![]()
上式は暗記しなくても、メタノールと水が反応して二酸化炭素と水素イオンができる、と覚えておけば係数の計算はその都度やったとしてもあまり時間のロスにはならないと思います。よって、この反応式から1molのメタノールから6molの水素イオンが生成します。
一方、脱窒素の化学反応式は次のようになります。
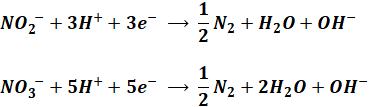
この問題ではNO3–の脱窒素が取り上げられていますが、併せてNO2–の脱窒素についても押さえておいてください。
これも先ほどの反応式と同様、係数ごと丸暗記するというよりは、亜硝酸態窒素(NO2–)または硝酸態窒素(NO3–)が水素イオンと反応して、窒素と水と水酸化物イオンが生成する、という流れを押さえておくことが重要です。係数合わせはあとからやればよいと思います。
上式より、NO3–の1molを脱窒素するために必要な水素イオンの量は5molとなります。水素イオン6molでメタノール1molに相当するので、NO3–の1molを脱窒素するために必要なメタノールのmol数は、
![]()
と計算することができます。

コメント