二次電池
二次電池も前項で解説した一次電池と大体の仕組みは同じです。ただし、一次電池は、貯蔵した化学エネルギーを必要に応じて電気エネルギーに変えて外部負荷に供給できるだけだったのに対し、二次電池はそれに加えて、電気エネルギーを化学エネルギーに変えて電池内に蓄えておくことができます。
つまり、放電だけでなく充電もでき、何度も繰り返し使用できるのが二次電池の特徴です。
二次電池には、鉛蓄電池やニカド電池などがありますが、特に有名な鉛蓄電池については化学反応式を詳細に押さえておきたいところです。
まず、鉛蓄電池の構成は以下の通りです。
鉛蓄電池:![]()
続いて、鉛蓄電池の充放電反応全体をまとめた化学反応式を以下に示します。
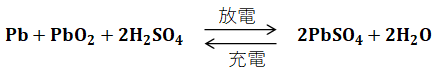
充電時の電極は正極が二酸化鉛(PbO2)、負極が鉛(Pb)ですが、放電後にはどちらも硫酸鉛(PbSO4)となります。つまり、上記の左側から右側への反応が放電で、反対に右側から左側への反応が充電です。
放電のときには正極の二酸化鉛は還元されて硫酸鉛になります(PbO2のPbの酸化数は+4ですが、PbSO4のPbの酸化数は+2なので、これは還元です)。
(放電・正極) ![]()
一方、同じく放電のとき、負極の鉛は酸化されて硫酸鉛になります(Pbは単体なので酸化数は0ですが、PbSO4のPbの酸化数は+2なので、これは酸化です)。
(放電・負極) ![]()
充電のときは上記の考え方を全く反対にすれば良いです。つまり、正極では硫酸鉛が酸化されて二酸化鉛になります(PbSO4のPbの酸化数は+2ですが、PbO2のPbの酸化数は+4なので、これは酸化です)。
(充電・正極) ![]()
また、負極では硫酸鉛が還元されて鉛になります(PbSO4のPbの酸化数は+2ですが、Pbは単体なので酸化数は0なので、これは還元です)。
(充電・負極) ![]()

コメント