問 題
定格出力600MW、定格出力時の発電端熱効率42%の汽力発電所がある。重油の発熱量は44000kJ/kgで、潜熱の影響は無視できるものとして、次の(a)及び(b)の問に答えよ。
ただし、重油の化学成分は質量比で炭素85%、水素15%、水素の原子量を1、炭素の原子量を12、酸素の原子量を16、空気の酸素濃度を21%とし、重油の燃焼反応は次のとおりである。
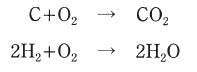
(a) 定格出力にて、1日運転したときに消費する燃料質量の値[t]として、最も近いものを次の(1)~(5)のうちから一つ選べ。
- 117
- 495
- 670
- 1403
- 2805
(b) そのとき使用する燃料を完全燃焼させるために必要な理論空気量※の値[m3]として、最も近いものを次の(1)~(5)のうちから一つ選べ。
ただし、1molの気体標準状態の体積は22.4Lとする。
※ 理論空気量:燃料を完全に燃焼するために必要な最小限の空気量(標準状態における体積)
- 6.8×106
- 9.2×106
- 32.4×106
- 43.6×106
- 87.2×106
解 説
(a)
定格出力が600[MW]であれば1秒間に600[MJ]発電しているので、1日では
![]()
となります。
これは出力であり、発電端効率は42%なので、入力(重油の発熱量)は
![]()
です。
重油の発熱量は44000[kJ/kg]=44000[MJ/t]なので、上記の熱量を生むための重油の消費量は以下の通り計算できます。
![]()
(b)
まず、燃料は(a)より2805[t]あり、そのうちの85%が炭素(C、分子量12)、15%が水素(H2、分子量2)なので、それぞれのモル数は次のように計算できます。
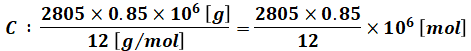
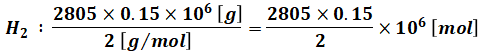
また、問題文に載っている化学反応式を見ると、炭素と水素をそれぞれ燃やすのに必要な酸素のモル比がわかります。
炭素のほうはCの係数とO2の係数がどちらも1(1とは書いてありませんが…)なので、炭素のモル数と同じモル数の酸素を消費します。
一方、水素のほうはH2の係数が2であるのに対してO2の係数は1なので、酸素の消費量は水素の半分となります。
よって、完全燃焼させるために必要な酸素のモル数は、
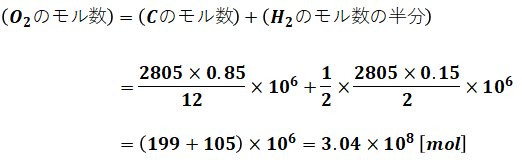
となります。
問題文より1[mol]は22.4[L]なので、酸素の体積は次のように計算できます。
![]()
ここでまた問題文を確認すると、空気中の酸素は21%であるので、空気量は次のような比の計算によって求めることができます。
![]()

コメント